電沉積法制備CuInS2薄膜
本文采用單步電沉積法和兩步電沉積法在Mo基底上制備CuInS2薄膜,用X射線衍射儀(XRD)和掃描電子顯微鏡(SEM)表征了樣品的結(jié)構(gòu)和形貌,用能量散射儀(EDX)測試了樣品中各元素含量。結(jié)果表明,電沉積法制備的樣品,元素原子比與沉積電位密切相關(guān);單步法制備的薄膜樣品,致密平整,晶粒大小1~2 μm,CuInS2晶體呈黃銅礦結(jié)構(gòu),同時含有CuS晶體;兩步法制備的CuInS2薄膜為黃銅礦結(jié)構(gòu),無雜相,但薄膜的致密平整性不如單步法。
CuInS2是I–III–VI2族直接能隙半導體化合物,禁帶寬度1.50 eV,對可見光的吸收系數(shù)高達105 cm-1數(shù)量級,以其作為太陽電池的光吸收層,厚度僅需l~2 μm,可極大地降低成本。據(jù)Meese J M等的理論計算,CuInS2薄膜太陽電池的光電轉(zhuǎn)換效率理論值超過30%,實驗室水平已達到12.5%,而且其抗干擾、抗輻射能力強,性能穩(wěn)定,制成的光伏器件使用壽命長。因此,CuInS2是薄膜太陽電池光吸收層最有前途的材料之一。
目前CuInS2薄膜的制備大致可以分為直接合成法和多步硫化法兩種。直接合成法包括單源、雙源或三源共蒸發(fā)法,原子層沉積法,離子層氣相反應法,電化學法,噴霧熱解法等,多步硫化法則須先用蒸發(fā)、濺射或電化學沉積等方法制備金屬預置層,然后再對其進行硫化來制備CuInS2薄膜。但是上述的大多數(shù)方法都必須在高真空條件下進行,對實驗條件和實驗設備的要求苛刻,不利于低成本大規(guī)模生產(chǎn)。用電沉積法制備CuInS2薄膜則無需高真空條件,同時其具有可實現(xiàn)大面積制備、能源消耗少、成本低、系統(tǒng)穩(wěn)定性好等優(yōu)點。電沉積法制備CuInS2薄膜有單步法、兩步法和多步法。目前對電沉積法制備CuInS2薄膜的研究較少,制備工藝也不成熟。單步電沉積法和兩步電沉積法各有優(yōu)劣,本文研究不同沉積電位對電沉積法制備CuInS2薄膜的影響,對比研究單步法和兩步法制備CuInS2薄膜,探索電沉積法制備CuInS2薄膜的最佳工藝。
1、實驗
電沉積法制備CuInS2薄膜的電解池采用三電極體系,其中Mo 片(25mm×20mm×0.15mm)為工作電極,Pt電極為輔助電極,飽和甘汞電極(SCE)為參比電極,Mo 片經(jīng)打磨-去離子水洗-20%wt 的NaOH 溶液煮沸清洗-電化學拋光處理。單步電沉積中電解液為10 mmol/L CuCl2,10mmol/L InCl3,50 mmol/L Na2S2O3 和200 mmol/LLiCl 的混合液,用稀鹽酸調(diào)節(jié)電解液pH 至3.0。其中,CuCl2、InCl3、Na2S2O3 分別作為Cu 源、In 源和S 源,LiCl 既有絡合劑的作用,又是合適的添加劑。電沉積過程采用恒壓模式,保持工作電極與參比電極間的電壓VSCE 恒定,常溫下沉積,時間為30 min,沉積后的樣品在低真空條件下350 oC 熱處理60 min。兩步電沉積法制備CuInS2 薄膜,電解液為10 mmol/L CuCl2,10 mmol/L InCl3 和200 mmol/L LiCl 的混合液,用稀鹽酸調(diào)節(jié)電解液pH至2.5。沉積電位為-1.1 V vs.SCE,常溫下沉積30 min,沉積后的樣品在硫氣氛中熱處理,250℃和500℃溫度下分別處理30 min。
用X射線衍射儀(Rigaku D/MAX-RB,Cu Kα λ=1.54056 Å/40 kV/60 mA)表征樣品的晶體結(jié)構(gòu),用掃描電子顯微鏡(SEM,JEOL JSM-6390)觀察樣品的微觀形貌,用能量散射儀(EDX,Bruker AXS Microanalysis Esprit 1.8)測試樣品中各元素含量。
2、實驗結(jié)果
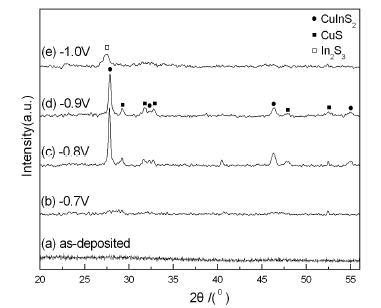
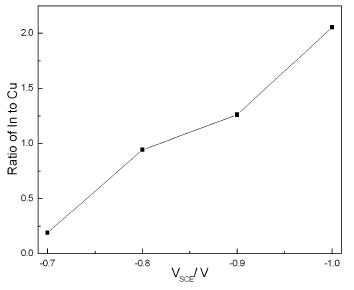

圖1 單步電沉積法不同沉積電位下薄膜的XRD 圖 圖2 單步電沉積法不同沉積電位下薄膜的In/Cu 原子比 圖3 單步電沉積法不同沉積電位下制備薄膜的SEM 圖
圖1為恒定反應物濃度、溶液pH值、沉積時間及熱處理溫度,改變沉積電位從-0.7 V到-1.0 V變化,用單步電沉積法制備的薄膜的XRD圖。
圖2為不同沉積電位時薄膜中In/Cu原子比。隨著沉積電位的增加,In/Cu原子比呈線性增加。沉積電位為-0.8 V和-0.9 V時,In/Cu原子比均在1.0附近,而其他沉積電位下,In/Cu原子比偏離1.0很大,尤其在低電位情況下,In元素析出量遠小于Cu。 實驗采用的電化學體系以飽和甘汞電極為參比電極,改變工作電極相對于參比電極的電壓VSCE,就改變了工作電極內(nèi)電子的能量。電解液與工作電極之間發(fā)生電子流動的臨界電勢與電解液中對應的化學物質(zhì)的標準電勢有關(guān)。實驗中,電解池內(nèi)發(fā)生反應的化學物質(zhì)的標準電勢如式(1)~(3)所示:
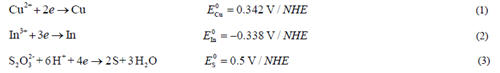
由能斯特方程推導出析出電位表達式如式(4)所示:
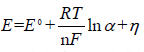 (4)
(4)
其中E0為相對標準氫電極電位,n 為參加反應的離子帶電荷數(shù),F(xiàn)為法拉第常數(shù),η為金屬離子在陰極上放電的過電位,由電極過程動力學因素以及有關(guān)參數(shù)決定,α 為金屬離子的平均活度。
由式(1),(2)可知Cu 和In 兩者的標準電勢相差很大,而析出電位越正的金屬離子越容易析出。Cu 元素的標準電勢遠高于In 元素,當沉積電位較低時,Cu 的析出電位高于In,Cu 元素更易析出,沉積樣品中Cu 元素含量遠高于In。增大沉積電位,可提高陰極極化強度,由式(4)可知,析出電位會隨之增加,減小不同元素析出電位的差距。隨著沉積電位增加,In/Cu 原子比增大。復合電沉積中,元素共沉積的條件是不同離子的析出電位相近。為得到理想配比的Cu、In 比例,調(diào)節(jié)沉積電壓以改變陰極的極化強度,使不同元素的析出電位接近。本實驗中,沉積電位為-0.8 V 和-0.9 V 時,Cu 元素和In 元素的原子比接近1.0,在該電位下沉積,能夠得到符合化學計量比的CuInS2 薄膜,圖1 所示的XRD 圖也能說明此點。