溶膠-凝膠法制備氮化鋁AlN粉體
AlN氮化鋁是Ⅲ-V族半導(dǎo)體化合物, 其晶體是以[AlN4]四面體為結(jié)構(gòu)單位的共價(jià)鍵化合物。25℃時(shí)晶格常數(shù)α0=3.1127,c0=4.9816,屬六方晶系,如圖1 所示。
AlN材料具有熱導(dǎo)率高(是Al2O3材料的8~10 倍) 、高溫電絕緣性好、介電性能好、熱膨脹系數(shù)低(4.4 ×10 - 6 ℃- 1 ) ,與單晶硅相近,比Al2O3 ,BeO還要低,耐熱沖擊電阻高、高溫下材料強(qiáng)度大、硬度高、無毒等優(yōu)異的性能,從而在諸多領(lǐng)域中得到廣泛應(yīng)用。
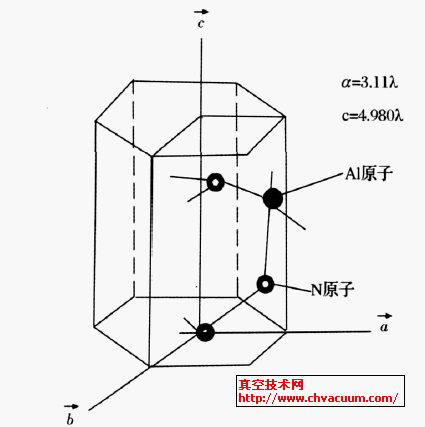
圖1 AlN晶胞結(jié)構(gòu)圖
在國際上用于混合集成電路(HIC)、微波集成電路(MIC)、電力電子模塊(GTRM、IGBTM)、激光二極管(LD)、坩堝、刀具材料等領(lǐng)域。尤其是它的熱膨脹與半導(dǎo)體硅材料相匹配并且無毒性、是較
理想的電子半導(dǎo)體封裝所用的支撐散熱材料,以取代BeO 等毒性大的材料,被認(rèn)為是下一代半導(dǎo)體基片和電子器件封裝的理想材料。目前AlN的合成方法主要有以下幾種: 鋁粉直接氮化法、碳熱還原法、氣相反應(yīng)法、裂解法、等離子體法、電弧熔煉法、自蔓延高溫合成法、微波合成法,前兩種方法已經(jīng)應(yīng)用于工業(yè)化大規(guī)模生產(chǎn),其中鋁粉直接氮化法為強(qiáng)放熱反應(yīng),反應(yīng)不易控制,反應(yīng)過程中放出的大量熱易使鋁形成融塊,造成反應(yīng)不完全,難以制備高純度、細(xì)粒度的產(chǎn)品。相比較而言,碳熱還原法制備的氮化鋁粉末純度高、性能穩(wěn)定、粉末粒度細(xì)小均勻、成形和燒結(jié)性能良好。而在制備氮化鋁前驅(qū)體時(shí)溶膠-凝膠法又以成分易分布均勻、顆粒細(xì)小勝過固相混合法。
本文采用溶膠-凝膠工藝,以鋁鹽與有機(jī)碳源混合,在一定溫度及PH值下凝膠化,在高溫下,干凝膠中的鋁鹽與有機(jī)碳源均發(fā)生化學(xué)分解,從而可以制備出分子水平均勻的鋁源與碳源的混合物,由于分解后鋁源與碳源均為非常細(xì)小的顆粒,同時(shí)混合的非常均勻,因此可以在較低的溫度下發(fā)生氮化反應(yīng),具有制備工藝簡單,氮化溫度低,AlN轉(zhuǎn)化率高,無雜相,含氮量高等特點(diǎn)。
1、實(shí)驗(yàn)
1.1、實(shí)驗(yàn)原料
硝酸鋁、有機(jī)碳、聚乙二醇、尿素、氨水均為分析純。
1.2、實(shí)驗(yàn)儀器
冷凍干燥機(jī),DTY21SL型(北京古生代粉體科技有限公司);真空碳管爐,定做;脫碳爐,KSY-12-16型(上海電爐廠) 。
1.3、實(shí)驗(yàn)方法
首先將硝酸鋁、有機(jī)碳、聚乙二醇等置于燒杯中,其中硝酸鋁與有機(jī)碳源的摩爾比為3,聚乙二醇的加入量為總量的5 ‰,然后加入去離子水溶解,將燒杯放入75℃恒溫水浴鍋中,加入一定量的尿素,邊攪拌邊滴加稀氨水溶液以獲得氧化鋁溶膠體,然后升高溫度蒸發(fā)掉大部分的水分,得到的凝膠體進(jìn)行冷凍干燥,形成AlN 前驅(qū)體,將其放入密閉的真空碳管爐中,邊抽真空邊升溫,使前驅(qū)體中的有機(jī)物在無氧存在的情況下逐漸脫去水并炭化,與氫氧鋁分解生成的氧化鋁形成混合均勻且疏松多孔的物質(zhì),通過控制氮?dú)饬魉偌安粩嗌郎?最終在1550℃氮化得到含碳的AlN ,然后用脫碳爐于還原氣氛下800 ℃脫碳,即得到AlN 粉體,然后對樣品做粒度、XRD、SEM 等檢測其物理化學(xué)性能。
1.4、分析儀器
掃描電子顯微鏡(J SM - 6360LV 日本電子公司) 、X2射線儀(X’Pert MPD Pro 日本電子公司) ,激光粒度分析儀等。
1.5、實(shí)驗(yàn)過程
實(shí)驗(yàn)過程中所發(fā)生的化學(xué)反應(yīng)如下:在溶膠-凝膠階段,主要發(fā)生尿素的水解反應(yīng)與鋁鹽的水解反應(yīng):
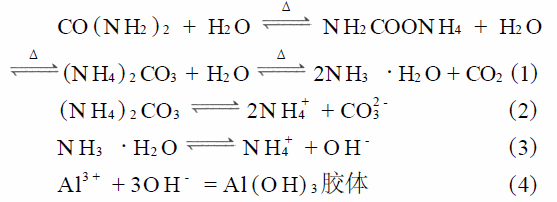
從式(1)~式(4) 可以看出,尿素?zé)岱纸獾倪^程就是形成氫氧化鋁的過程,同時(shí)溶解在水中的有機(jī)化合物被均勻地固定在了氫氧化鋁周圍。在燒結(jié)階段主要發(fā)生鋁膠與有機(jī)物的分解反應(yīng)如式(5),式(6),其中式(6)為不完全的氧化反應(yīng),可以生成很多種化合物,諸如短鏈的烷烴等。經(jīng)過燒結(jié),在溶膠-凝膠階段固化在凝膠中的有機(jī)化合物變成了很細(xì)小的單質(zhì)碳。
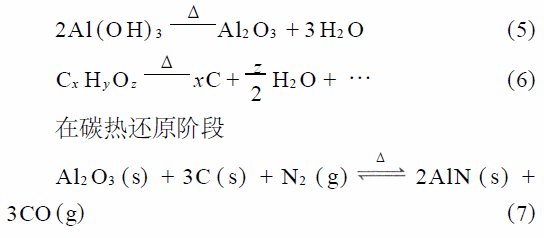
2、實(shí)驗(yàn)結(jié)果與討論
2.1、XRD分析
圖2 為AlN 樣品的XRD 分析圖,從圖2 可以看出幾乎沒有雜相,衍射峰較尖銳,說明AlN 粉體的純度已經(jīng)很高,并且結(jié)晶完整,碳也被脫除干凈。
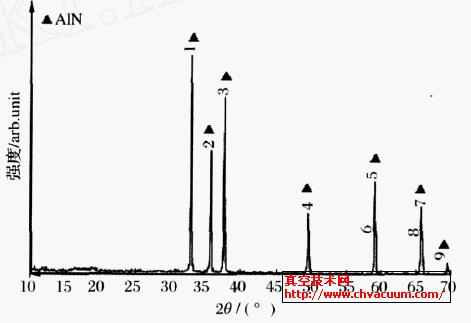
圖2 氮化鋁XRD分析
2.2、SEM分析
圖3 是氮化鋁粉末放大2000倍的電鏡照片,從圖中可以看出,由這種工藝所制備的AlN粉體粒度均勻,沒有大團(tuán)聚,比較松散。圖4 是氮化鋁粉末放大5000倍的電鏡照片,從圖中可以看出,氮化鋁單晶粒度小于1μm。


圖3 AlN 粉末放大2000倍的電鏡照片圖4 氮化鋁粉末放大5000倍電鏡照片
3、結(jié)論
本方法是一種很好的制備AlN粉體的方法,用這種方法制備AlN粉體具有以下優(yōu)點(diǎn):
(1) 氮化溫度低,較氧化鋁與碳粉混合還原法約低100℃;
(2) AlN純度高,雜相少,基本所有的氧化鋁都轉(zhuǎn)變成了AlN。
(3) 晶粒細(xì)小,為亞微米級。