液相電化學(xué)沉積類金剛石薄膜的研究進(jìn)展
采用電化學(xué)沉積法開展液相中類金剛石薄膜的制備工藝和理論的研究,對(duì)于完善類金剛石薄膜的合成技術(shù),開拓類金剛石薄膜的應(yīng)用領(lǐng)域,具有很重要的理論意義和實(shí)用價(jià)值。本文概述了液相電沉積技術(shù)的基本原理和方法,重點(diǎn)從四個(gè)方面介紹了電化學(xué)方法制備類金剛石薄膜的研究進(jìn)展,總結(jié)了該方法所制備樣品的性能,并對(duì)可能的反應(yīng)機(jī)制作了綜合性的闡述,最后對(duì)液相電沉積類金剛石薄膜的發(fā)展前景進(jìn)行了展望。
類金剛石碳(即Diamondlike Carbon ,簡(jiǎn)稱DLC) 膜是一種在多方面性質(zhì)(機(jī)械、光學(xué)、電學(xué)、化學(xué)和摩擦學(xué)特性等) 都類似于金剛石的非晶碳膜。DLC 膜由于具有硬度高、摩擦系數(shù)低、耐磨性好、化學(xué)惰性和從紅外到紫外較寬范圍內(nèi)的高透射比等一系列優(yōu)點(diǎn),可以廣泛應(yīng)用于機(jī)械、電子、化學(xué)、軍事和航空航天等領(lǐng)域。因此,DLC 薄膜的研究在近20 年中得到了廣泛關(guān)注。
目前,類金剛石碳膜的制備一般用物理氣相沉積法和化學(xué)氣相沉積法等基于氣相的合成方法,如離子束沉積、脈沖激光沉積和等離子體增強(qiáng)化學(xué)氣相沉積等,采用這些氣相方法一般都可以得到高質(zhì)量的DLC 膜,沉積速度也很快。但是它們一般要求較高的基底溫度,大面積成膜較為困難;同時(shí),在氣相條件下沉積,需要的設(shè)備比較復(fù)雜,價(jià)格較高,在一定程度上限制了類金剛石薄膜的進(jìn)一步發(fā)展。
Maissel 等在《薄膜工藝手冊(cè)》一書中指出,大多數(shù)能夠在氣相中沉積的薄膜材料也能在液相中通過電化學(xué)方法合成,并且反之亦然。同氣相沉積相比,液相電沉積具有許多優(yōu)點(diǎn),如:
(1) 一般可在常溫常壓下進(jìn)行;
(2) 易控制電極反應(yīng)的方向;
(3) 可通過調(diào)節(jié)電極電位來改變反應(yīng)的速度;
(4) 適宜工業(yè)化生產(chǎn),在平整表面和不規(guī)則表面均能大面積成膜;
(5) 環(huán)境污染少,利于環(huán)境保護(hù)。
傳統(tǒng)的電化學(xué)合成和電化學(xué)沉積技術(shù)大多是在離子性的水溶液或有導(dǎo)電介質(zhì)的有機(jī)溶液中進(jìn)行,溶液的導(dǎo)電能力很好,因而合成過程中只需施加很小的電壓就能完成反應(yīng)。但電化學(xué)沉積法制備DLC薄膜采用含碳的純凈有機(jī)溶液作為電解質(zhì),這些有機(jī)溶劑在一般條件下不會(huì)離解成離子,極化程度也很弱。因此通常在兩個(gè)電極之間施加很高的電壓,即利用強(qiáng)電場(chǎng)使溶液中的C-H、C-O 和O-H 等鍵發(fā)生斷裂生成“碳碎片”,從而使含碳的成分以極性基團(tuán)或離子的形式到達(dá)基片,并且在基片所處的高電位下得以活化,進(jìn)而生成含一定sp3 成分的類金剛石薄膜。
1、基本實(shí)驗(yàn)過程
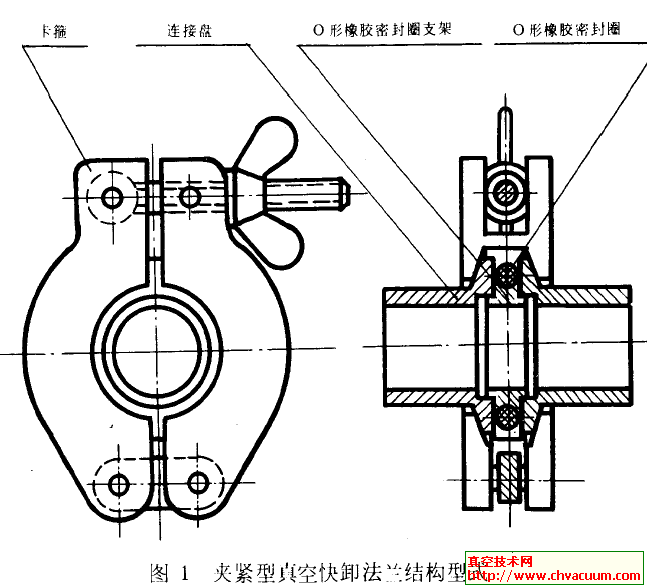
電解有機(jī)溶液法制備類金剛石薄膜的基本實(shí)驗(yàn)裝置類似于電解池,如圖1 所示。一般采用高壓直流電源,以待鍍材料為陰極,石墨電極做陽(yáng)極。電源電壓可在0~3000V 之間變化,電極間距一般較小。常用電壓為500~2000V ,反應(yīng)溫度介于室溫和100 ℃之間。與普通電解池的不同之處在于它一般以導(dǎo)電性不好的有機(jī)試劑作為電解液。放置在陰極的襯底材料通常為硅片,隨著近幾年研究的不斷深入和進(jìn)展, 鋁和導(dǎo)電玻璃等逐漸發(fā)展成較為廣泛使用的基體材料,此外鎳箔也在人們的嘗試下成為制備類金剛石薄膜的襯底材料。陽(yáng)極有不同的形式,大部分的實(shí)驗(yàn)采用了高純石墨片為陽(yáng)極,也有采用以鉑絲或鎢絲作為點(diǎn)電極進(jìn)行電沉積的。
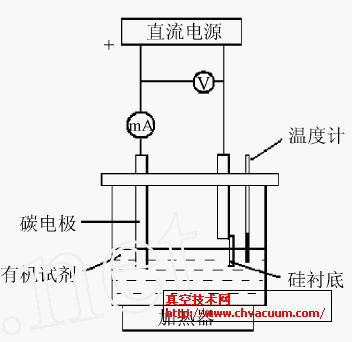
圖1 實(shí)驗(yàn)裝置示意圖
2、液相電沉積工藝的探索
1992 年,Namba首次在溫度低于70 ℃的條件下,采用高電壓( > 1000V) 電解純凈乙醇溶液的方法,得到了主要成份為無定形碳的薄膜,為液相合成金剛石和類金剛石薄膜作出了有益的嘗試,標(biāo)志著在液相有機(jī)電解質(zhì)溶液中采用電化學(xué)方法制備類金剛石材料的開端。至此,液相電沉積法開始得到極大的重視,近年來,DLC 薄膜電化學(xué)制備技術(shù)得到了迅速發(fā)展,工藝逐漸成熟。
2.1、電流密度影響因素的研究
電化學(xué)反應(yīng)是通過電流來完成電子的轉(zhuǎn)移過程,電流密度反映的是單位時(shí)間內(nèi)通過截面的電子數(shù)目,電流密度越大,表明電極反應(yīng)的速度越快。由于電化學(xué)方法制備類金剛石薄膜的關(guān)鍵步驟是有機(jī)分子在電極表面發(fā)生電化學(xué)反應(yīng),所以體現(xiàn)這一反應(yīng)進(jìn)行情況的電流密度,在薄膜的形成過程中扮演著重要的角色。因此探討影響電流密度的因素,找出沉積DLC 薄膜的最佳條件成為研究者的重點(diǎn)研究方向。、Namba首先發(fā)現(xiàn)以乙醇為電解液進(jìn)行電解,在一定溫度和電壓下,電流密度隨著反應(yīng)時(shí)間的延長(zhǎng)而逐漸減小。隨后,Wang 等發(fā)現(xiàn),對(duì)于相同的電解質(zhì)溶液,在相同的溫度下,電壓越高,電流密度越大。他們分別以甲醇、乙醇、丙酮及四氫呋喃為電解液,發(fā)現(xiàn)對(duì)于任何一種電解質(zhì)溶液,電流密度與電壓都呈線性關(guān)系,但是在相同的溫度和電壓下,不同電解質(zhì)溶液的電流密度大小不同。Guo 等發(fā)現(xiàn),在其它條件不變的情況下,電流密度隨著溫度的升高和電極間距的減小而增大。隨著研究的不斷深入,Wang 等在Namba 的基礎(chǔ)上探討了電流密度隨著反應(yīng)時(shí)間的延長(zhǎng)而逐漸減小的原因,認(rèn)為這是由于襯底表面生成了電阻率較大的碳膜造成的。
在上述研究的基礎(chǔ)上,人們又繼續(xù)研究了基底材料對(duì)電流密度的影響。對(duì)于鋁片和硅片,隨著電解過程的進(jìn)行,電流密度均是先增大后減小,導(dǎo)電玻璃則是一開始就迅速減至很小,然后基本不變。對(duì)于前者,電流密度在起始階段的增加,可能是由于有機(jī)分子在電場(chǎng)的作用下離解成帶電的分子碎片,一定程度上增加了溶液的導(dǎo)電能力。隨著反應(yīng)的不斷進(jìn)行,在襯底表面生成了電阻率很大的類金剛石薄膜,極大地降低了襯底材料的導(dǎo)電能力,因而電流密度又出現(xiàn)大幅下降的趨勢(shì)。對(duì)于導(dǎo)電玻璃,電流密度出現(xiàn)特殊規(guī)律的原因尚在進(jìn)一步的研究中。但足以可見,不同的襯底的表面狀態(tài)對(duì)沉積過程中電流密度的變化狀況有很大的影響。
2.2、電解質(zhì)溶液選擇標(biāo)準(zhǔn)的確立
Fu 等探索了電解質(zhì)溶液的性質(zhì)對(duì)電流密度大小的影響,分別嘗試從乙醇、甲醇、硝基甲烷、N , N2二甲基甲酰胺(DMF) 和乙腈中沉積DLC 薄膜,發(fā)現(xiàn)在同樣的條件下電流密度隨著碳源的介電常數(shù)的增加而增大。隨后,酒金婷等在前人對(duì)影響電流密度因素研究的基礎(chǔ)上,總結(jié)出了碳源的選擇原則,指出液相電沉積類金剛石薄膜的碳源應(yīng)符合如下條件: (1) 碳源具有較高的介電常數(shù); (2) 碳源的粘滯系數(shù)小;(3) 碳源分子中的CH3 或CH(4 - n) +n 基團(tuán)需與極性基團(tuán)鍵合。
利用電化學(xué)沉積類金剛石薄膜是在非導(dǎo)電性的有機(jī)介質(zhì)中進(jìn)行的,介質(zhì)中不含離子,主要靠有機(jī)分子的極化導(dǎo)電。具有高介電常數(shù)的有機(jī)液體將有利于分子的極化,增加反應(yīng)的電流密度,是適合液相沉積DLC 薄膜的碳源。盡管碳源的介電常數(shù)越大越有利于沉積薄膜,但僅有大介電常數(shù)的碳源并不能獲得理想的結(jié)果。有機(jī)溶液一般都具有一定的粘度,其粘度大小是影響沉積結(jié)果的又一因素。碳源粘度較大,其流動(dòng)性就較差,將阻礙粒子的擴(kuò)散并增加粒子在電極表面的停留時(shí)間,降低電極表面參加反應(yīng)的粒子數(shù)目,從而使反應(yīng)速率降低。因此,液相沉積DLC 薄膜不僅要求碳源的介電常數(shù)要高而且其黏度要小。此外,包含有活性甲基(分子中甲基直接與極性基團(tuán)鍵合) 的碳材料是適合沉積薄膜的碳源,因?yàn)樵诜磻?yīng)過程中甲基容易斷鍵生成活性中間體,這與氣相沉積結(jié)果類似。
根據(jù)這樣的標(biāo)準(zhǔn),在所有經(jīng)常被用作碳源的物質(zhì)中,乙腈是最好的選擇,其次是N , N2二甲基甲酰胺,排在第三位的是甲醇,乙醇位居第四。