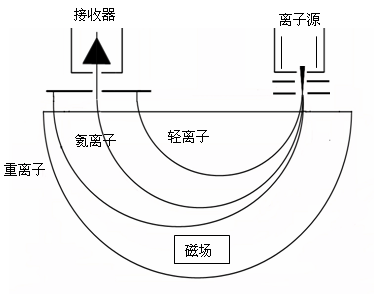
理想氣體的基本定律和理想氣體狀態方程
本章節介紹的理想氣體定律和理想氣體狀態方程,主要包括波義耳-馬略特定律、蓋·呂薩克定律、查理定律、道爾頓定律、阿佛加德羅定律,是針對平衡狀態下的理想氣體得出的。不過,常溫(與室溫相比)低壓(相對大氣壓而言)下的各種氣體都可以看作是近似程度相當好地理想氣體,因此,我們可以放心地把這些定律和公式應用于真空工程的絕大部分計算之中。這其中包括通常所涉及到的各種氣體,甚至于接近飽和的蒸汽(如水蒸汽);也包括各類氣體狀態過程,甚至于明顯的非平衡狀態(如氣體的流動過程)。
氣體的壓力p(Pa)、體積V(m3)、溫度T(K)和質量m(kg)等狀態參量間的關系,服從下述氣體實驗定律:
1、波義耳-馬略特定律
一定質量的氣體,若其溫度維持不變,氣體的壓力和體積的乘積為常數
pV = 常數 (1)
2、蓋·呂薩克定律
一定質量的氣體,若其壓力維持不變,氣體的體積與其絕對溫度成正比
V/T = 常數 (2)
3、查理定律
一定質量的氣體,若其體積維持不變,氣體的壓力與其絕對溫度成正比。
p/T = 常數 (3)
上述三個公式習慣上稱為氣體三定律。具體應用方式常為針對由一個恒值過程連結的兩個氣體狀態,已知3個參數而求第4個參數。例如:初始壓力和體積為P1、V1,的氣體,經等溫膨脹后體積變為V2,則由波義耳--馬略特定律,可求得膨脹后的氣體壓力為P2 = P1V1/V2。這正是各種容積式真空泵最基本的抽氣原理。
4、道爾頓定律
相互不起化學作用的混合氣體的總壓力等于各種氣體分壓力之和。
P = P1 + P2+····+ Pn (4)
這里所說的混合氣體中某一組分氣體的分壓力,是指這種氣體單獨存在時所能產生的壓力。
道爾頓定律表明了個組分氣體壓力的相互獨立和可線性疊加的性質。
5、阿佛加德羅定律
等體積的任何種類氣體,在同溫度同壓力下均有相同的分子數;或者說,在溫度同壓力下,相同分子數目的不同種類氣體占據相同的體積。1mol任何氣體的分子數目叫做阿佛加德羅數,NA = 6.022×1023mol-1。在標準狀態下(po = 1.01325×105Pa,To = 0oC),1mol任何氣體的體積稱為標準摩爾體積,Vo = 2.24×10-2m3mol-1。
根據上述氣體定律,可得到反映氣體狀態參量p、V、T、m之間定量關系的理想氣體狀態方程:
pV = m/M(RT) (5)
式中的M為氣體的摩爾質量(kg/mol),R為普適氣體常數,R=8.31J/(mol·K)。在已知p、V、T、m四參量中的任意三個量時,可由此式求出另外一個值。例如氣體的質量m = pVM/(RT)
一定質量的氣體,由一個狀態(參量值為p1、V1、T1)經過任意一個熱力學過程(不必是恒值過程)變成另一狀態(參量值為p2、V2、T2),根據狀態方程,可得到關系式:
p1V1/T1 = p2V2/T2 (6)
對(5)變換,還可計算單位體積空間內的氣體分子數目和氣體質量,即氣體分子數密度n(m-3)和氣體密度p(kg/m3)
n = mNA/MV = pNA/RT = p/kT (7)
p = m/V = pM/RT (8)
系數k = R/NA = 1.38×1023J/K 稱為波爾茲曼常數。